Матикенова А.А., Матвеева А.А.
Саратовский государственный университет имени Н.Г. Чернышевского, Российская Федерация
СИНТЕЗ И СТРОЕНИЕ ГИДРО-4Н-СПИРО [1,2,3,4] ТЕТРАЗОЛО [ 5,1-b ] 5,6-ЦИКЛОАЛКАПИРИМИДИН-7,1-ЦИКЛОАЛКАНОВ
Ранее нами сообщалось о синтезе тетразолопиримидинов , аннелированных карбоциклами С 6 -С 8 посредством трехкомпонентной циклоконденсации (5-аминотетразол, альдегид, циклокетон ) [1]. Реакция протекает региоспецифично с образованием тетразолопиримидинов с линейным сочленением колец.
Анализируя возможные направления формирования последних, мы предположили, как один из возможных путей, первоначальное образование азометинациклоалканона .
При кипячении реагентов ( циклогекса ( гепта , окта)нон, 5-амино-1,2,3,4-тетразол ) 1-1,5 час в отсутствии растворителя и последующем охлаждении выпадают кристаллы гидро-4Н-спиро [1,2,3,4] тетразоло [ 5,1-b ] 5,6-циклоалкапиримидин-7,1-циклоалканов 1 а-с с выходами 50-56%:
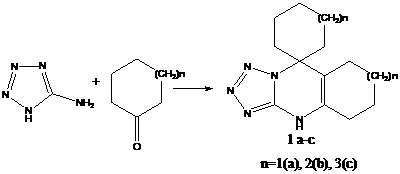
Характеристичными в ЯМР 1 Н спектрах соединений 1 а-с являются синглетNH протона (9.60–10.03 м.д.) и сигналы протонов алициклов (2.37–1.22 м.д.).
В спектрах ЯМР 13 С присутствуют сигналы характеристичного спироциклического атома углерода (63.79–67.52), sp 2 , sp 3 гибридных атомов углерода, число которых соответствует строению соединений 1 а-с .
Однако по спектрам ЯМР 1 Н и 13 С нельзя судить о молекулярной структуре полученных спиранов . Для однозначного установления строения, конформационных особенностей и кристаллической структуры один из представителей ряда4,7-дигидро-4Н-спиро [1,2,3,4] тетразоло [ 5,1-b ] 5,6-циклогексапиримидин-7,1-циклогексан,выделенный в виде хорошо образованных кристаллов из раствора ДМФА и 2-пропанол в соотношении 1:1 был подвергнут РСА . На рис. приведен общий вид соединения 1а в кристалле.
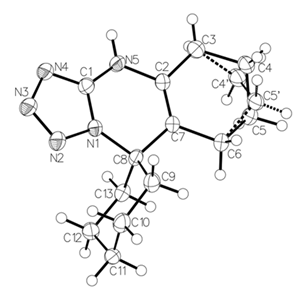
Рис. 1/ Общий вид соединения 1а в кристалле. Атомы представлены эллипсоидами тепловых колебаний ( p=50% )
Молекула имеет трициклическую систему, состоящую из линейно сочлененных тетразольного , дигидропиримидинового и циклогексанового циклов. Спиросочлененное циклогексановое кольцо расположено практически перпендикулярно к плоскости дигидропиримидинового фрагмента (торсионные углы С(1)- N (1)-С(8)-С(13) и С(2)-С(7)-С(8)-С(9) равны соответственно -98,48(18) и -137,57(13) o ) и находится в конформации кресло.
При конденсированное циклогексановое кольцо находится в форме искаженного полукресла . Фрагмент его «насыщенной» части приближен к конфигурации циклогексанового кольца (торсионный угол С(3)-С(4)-С(5)-С(6) составляет -61.6(3) ? ). Фрагмент кольца в области двойной связи почти выплощен : торсионный угол С(3)-С(2)-С(7)-С(6) равен -1.2(3) ? . Торсионный угол С(2)- N (5)-С(1)- N (1) (-11.1(2)),свидетельствует о сопряжении тетразольного цикла и NH-группы.
Наличие атома водорода при атоме азотаN (5) с длиной связи N (5)-Н( 5N ) 0.882(17) ? подтверждает енаминную , а не альтернативную иминную форму гидропиримидинового кольца.
Такое неожиданное направление реакции (образование спиранов 1 а-с ) можно представить через промежуточное образование азометиновцикланонов с их последующей конденсацией с исходным кетоном.
Следует отметить, что в работе [2] при взаимодействии 3-амино-1,2,4-триазола с циклогексаноном получена спироциклическая система родственного строения с иным расположением спироуглеродного атома.
Таким образом, нами синтезированы гидро-4Н-спиро [1,2,3,4] тетразоло [ 5,1-b ] 5,6-циклоалкапиримидин-7,1-циклоалканы и установлено их строение.
Список использованных источников:
1. Матвеева А.А. Трехкомпонентная циклоконденсация в синтезе азолоцикланопиримидинов / [А.А. Матвеева и др.] // Современные проблемы химической науки и образования: сб. материалов Всерос . конф . с междунар . участием, посвященной 75-летию со дня рождения В.В. Кормачева : в 2 т. – Т. I. – Чебоксары: Чуваш. ун-т, 2012. – С. 130–131.
2. Десенко С.М. Образование производных 1,2,4-триазолохиназолинов в реакциях 3-амино-1,2,4-триазолов с циклогексаноном / С.М. Десенко , В.Д. Орлов, К.Х. Эстрада // ХГС . – 1990. – №7. – C. 999.