Мандзюк Л. З. ** , к.х.н. Остап’юк Ю. В. * , к.х.н . Боднарчук О. В. ** , к.х.н. Матійчук В. С. * , д.х.н. Обушак М. Д. *
* Львівський національний університет імені Івана Франка, Україна ;
** Івано-Франківський національний медичний університет , У країна
ЦИКЛІЗАЦІЇ ЗАМІЩЕНИХ
2-(3-АРИЛ-4,5-ДИГІДРО-1 H -5-ПІРАЗОЛІЛ)ФЕНОЛІВ
З АРОМАТИЧНИМИ АЛЬДЕГІДАМИ
Взаємодією 2-( 4,5-дигідро-1 Н -5-піразоліл)фенолів з карбонільними сполуками можна одержувати похідні бензо [ e ] піразоло [1,5- c ][1,3] оксазинів . Завдяки доступності та варіативності реагентів така схема є перспективною для одержання широкого кола сполук цього класу. Досліджуючи межі застосування такого синтетичного підходу, ми випробували у згаданій реакції широке коло вихідних реагентів. На першій стадії, виходячи із галоген- , метил- і алкоксизаміщених ацетофенонів 1 та моно- і дизаміщених саліцилових альдегідів 2 , одержували халкони 3 . Встановлено, що всі одержані кетони – заміщені 3-(2-гідрокси-R 2 -феніл)-1-арилпропенони 3 – гладко циклізуються при дії гідразину з утворенням дигідропіразолінів 4 .
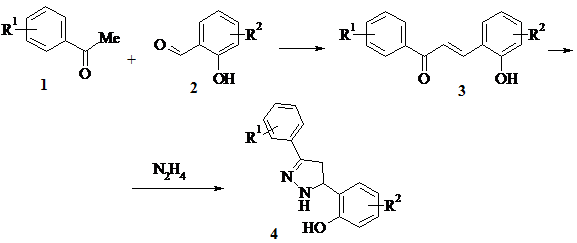
R 1 = H, 4-F, 4-Cl, 4-Br, 4-Me, 3-OMe, 4-OMe, 4-OEt, 4-OBu, 4-OPr- i , 4-OAllil, 2,5-Me, 3,4-( OMe ) 2 .
R 2 = H, 5-Cl, 5-Br, 5-NO 2 , 5-OMe, 3-OEt, 3,5-Cl 2 , 4,5-Cl 2 , 3,5-Br 2 , 3-OMe-5-Br.
Далі досліджували взаємодію піразолінів 4 з низкою ароматичних альдегідів 5 , які містили замісники різної природи (R 3 ). З’ясовано, що сполуки 4 реагують з усіма випробуваними ароматичними альдегідами 5 під час нагрівання в розчиннику (частіше – в етанолі) впродовж 0,5–4 год. У ході такої реакції 2-(3-арил-4,5-дигідро-1 Н -5-піразоліл)феноли замикають 1,3-оксазиновий цикл за участю фенольного гідроксилу і NH-групи піразолінового циклу, утворюючи 2,5-дизаміщені 9-хлор-1,10b-дигідробензо[e] піразоло [1,5-c][1,3] оксазини 6 .
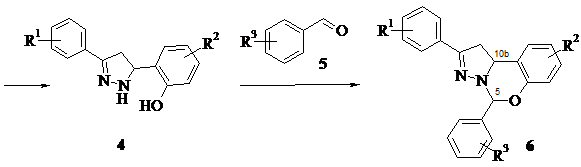
R 3 = H, 3-F, 4-F, 2-Cl, 3-Cl, 4-Cl, 3-NO 2 , 4-NO 2 , 4-Me, 4-Et, 4-Pr- i , 4-Bu- t , 3-OMe, 4-OMe, 2-OEt, 4-OEt, 4-OPr, 2-OPr- i , 4-OPr- i , 4-OBu, 4-OBu- t , 4-OC 5 H 11 , 4-OC 6 H 13 , 4-OC 7 H 15 , 4-OC 8 H 17 , 4-OAllil, 4-CF 3 , 4-SMe, 4-COOMe, 4-NMe 2 , 2-OCH 2 Ph, 4-OCH 2 Ph, 4-OCH 2 C 6 H 4 Cl-4, 4-OCH 2 C 6 H 4 Br-4, 4-OCH 2 C 6 H 4 Me-4, 4-OCOPh, 3,4-F 2 , 2,4-Cl 2 , 2,3-( OMe ) 2 , 2,5-( OMe ) 2 , 3,4-( OMe ) 2 , 3-Br-4-Me, 3-Br-4-OMe, 3-OMe-4-OC 4 H 9 , 3-OMe-4-OC 5 H 11 , 3-OMe-4-OC 6 H 13 , 3-OMe-4-OC 6 H 13 , 3-OMe-4-OAllil, 3-OMe-4-OCH 2 Ph, 2,3,4-( OMe ) 3 , 3,4,5-( OMe ) 3 , 3-Br-4-OCOMe-5-OMe, 3-Br-4-OCOPh-5-OMe, 3-Br-4-(OCOC 6 H 4 Me-4)-5-OMe.
Утворення оксазинового циклу на цій стадії відбувається незалежно від природи замісників R 3 у бензольному ядрі альдегідів 5 , хоча в разі застосування альдегідів з електронодонорними замісниками реакція триває довше і виходи сполук 6 дещо знижуються.
Крім того, використавши на першій стадії (синтез халконів ) 2-ацетилнафталін та метилетилкетон , за цією ж схемою одержали сполуки 7 і 8 :

Зважаючи на наявність двох хіральних центрів у сполуках 6 – 8 , можливе утворення стереоізомерів. Про це судили на підставі даних спектрів ЯМР 1 Н. Аналізуючи спектри ЯМР 1 Н сполук 6 – 8 , ми з’ясували, що у цих реакціях може утворюватись як один з двох ізомерів, так і їхня суміш у різних співвідношеннях. Слід зазначити, що, згідно з літературними даними, взаємоперетворенню двох ізомерів можуть сприяти слідові домішки кислот.
Нееквівалентні протони групи СН 2 у піразоліновому циклі в усіх випадках дають два сигнали в ділянці 3,2–3,6 м.ч ., причому один з них є дублетом дублетів, характерним для спінової системи АВХ (фрагмент СН 2 СН), а інший – дублетом ( гемінальна спін-спінова взаємодія). Хімзміщення сигналів протонів груп СН і NCHO (10b-Н і 5-Н) для двох ізомерів значно відрізняються. В одному з них спостерігаємо дублет при 4,7–4,8 м.ч . (10b-Н) і синглет 5-Н при ~ 6,7 м.ч ., а в іншому – сигнали при 5,3–5,4 м.ч . (дублет, 10b-Н) і 6,15–6,3 ( синглет 5-Н).
Таким чином, доступність та широкий вибір вихідних реагентів і варіативність замісників R 1 –R 3 дає змогу одержувати комбінаторні бібліотеки дигідробензо [ e ] піразоло [1,5- c ][1,3] оксазинів 6 – 8 з різноманітними замісниками і робить їх перспективними для досліджень на біологічну активність .